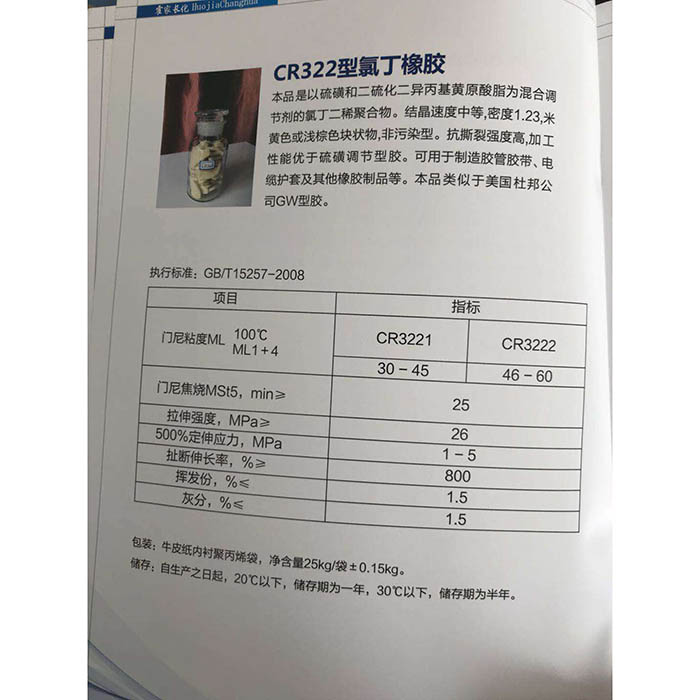
Natrijev hidroksid
Natrijev hidroksid, čija je kemijska formula NaOH, obično je poznat kao kaustična soda, kaustična soda i kaustična soda. Kada se otopi, ispušta miris amonijaka. Jaka je kaustikalužina, koji je općenito u obliku pahuljica ili granula. Lako je topiv u vodi (kada se otopi u vodi, daje toplinu) i stvara lužnatu otopinu. Osim toga, raspršuje se i lako apsorbira vodenu paru (razlivanje) i ugljični dioksid (propadanje) u zraku. NaOH je jedna od potrebnih kemikalija u kemijskim laboratorijima, a također je i jedna od uobičajenih kemikalija. Čisti proizvod je bezbojni i prozirni kristal. Gustoća 2,130 g/cm. Talište 318,4 ℃. Točka ključanja je 1390 ℃. Industrijski proizvodi sadrže malu količinu natrijevog klorida i natrijevog karbonata, koji su bijeli i neprozirni kristali. Postoje kockasti, ljuskavi, zrnasti i štapićasti. Tipska količina 40.01
Natrijev hidroksidmože se koristiti kao alkalno sredstvo za čišćenje u tretmanu vode, koje je otopljeno u etanolu i glicerolu; Netopljiv u propanolu i eteru. Također korodira ugljik i natrij na visokoj temperaturi. Reakcija disproporcionalnosti s halogenom kao što su klor, brom i jod. Neutralizirati kiselinama da nastane sol i voda.
Fizička svojstva savijanja
Natrijev hidroksid je bijela prozirna kristalna krutina. Njegova vodena otopina ima opor okus i satenski osjećaj.
Sklopivi deliquescence U zraku je tanjir.
Preklopna apsorpcija vode
Čvrsta lužina je vrlo higroskopna. Kada je izložen zraku, apsorbira molekule vode u zraku i konačno se potpuno otapa u otopinu, ali tekući natrijev hidroksid nema higroskopnost.
Topljivost na sklapanje
Preklopna alkalnost
Natrijev hidroksid će se potpuno disocirati na natrijeve ione i hidroksid ione kada se otopi u vodi, tako da ima općenito alkaliju.
Može provesti reakciju kiselo-bazne neutralizacije s bilo kojom protonskom kiselinom (koja također pripada reakciji dvostruke razgradnje):
NaOH + HCl = NaCl + H2O
2NaOH + H₂SO₄=Na2SO4+2H2O
NaOH + HNO₃=NaNO3+H2O
Slično, njegova otopina može podvrgnuti reakciji dvostruke razgradnje s otopinom soli:
NaOH + NH4Cl = NaCl +NH3·H2O
2NaOH + CuSO₄= Cu(OH)₂↓+ Na2SO₄
2NaOH+MgCl₂= 2NaCl+Mg(OH)₂↓
Preklopna reakcija saponifikacije
U mnogim organskim reakcijama natrijev hidroksid također igra sličnu ulogu katalizatora, među kojima je najreprezentativnija saponifikacija:
RCOOR' + NaOH = RCOONa + R'OH
Sažmi drugo
Razlog zašto se natrijev hidroksid lako razlaže u natrijev karbonat (Na₂CO₃) u zraku je taj što zrak sadrži ugljični dioksid (co):
2NaOH + CO₂ = Na2CO3 + H2O
Ako se kontinuirano unosi prekomjerna količina ugljičnog dioksida, nastat će natrijev bikarbonat (NaHCO₃), uobičajeno poznat kao soda bikarbona, a jednadžba reakcije je sljedeća:
Na₂CO₃ + CO₂ + H2O = 2NaHCO₃
Slično, natrijev hidroksid može reagirati s kiselim oksidima kao što su silicij dioksid (SiO₂) i sumporov dioksid (SO):
2NaOH + SiO₂ = Na2SiO3 + H2O
2 NaOH+SO (u tragovima) = Na2SO3+H2O
NaOH+SO₂ (previše) = NaHSO₃ (generirani NASO i voda reagiraju s prekomjernim SO kako bi se stvorio nahSO)